Naldemedin (Rizmoic®) ▼
(frühe Nutzenbewertung)
In Kürze
- Naldemedin ist zugelassen zur Behandlung von Opioid-induzierter Obstipation (OIC, opioid-induced constipation) bei Erwachsenen, die früher bereits mit einem Abführmittel behandelt wurden.
- Für das IQWiG und die AkdÄ war der Zusatznutzen nicht belegt.
- Auch in einem Addendum zur Nutzenbewertung kam das IQWiG zur selben Bewertung.
- Der G-BA beschloss, dass der Zusatznutzen nicht belegt ist.
Naldemedin ist ein Naltrexon-Derivat, das chemisch so verändert wurde, dass es die Blut-Hirn-Schranke nicht überqueren kann. Zudem ist Naldemedin ein Substrat des P-Glykoprotein (P-gp)-Effluxtransporters, der möglicherweise ebenfalls dazu beiträgt, dass Naldemedin nicht in das ZNS eindringt. Naldemedin antagonisiert die Opioidbindung an den μ-, δ- und κ-Opioidrezeptoren im Gastrointestinaltrakt und vermindert dadurch die obstipierenden Wirkungen von Opioiden, ohne die ZNS-vermittelten Opioideffekte aufzuheben.
Der Gemeinsame Bundesausschuss (G-BA) legte die folgende Fragestellung fest und definierte dazu die zweckmäßige Vergleichstherapie (ZVT):
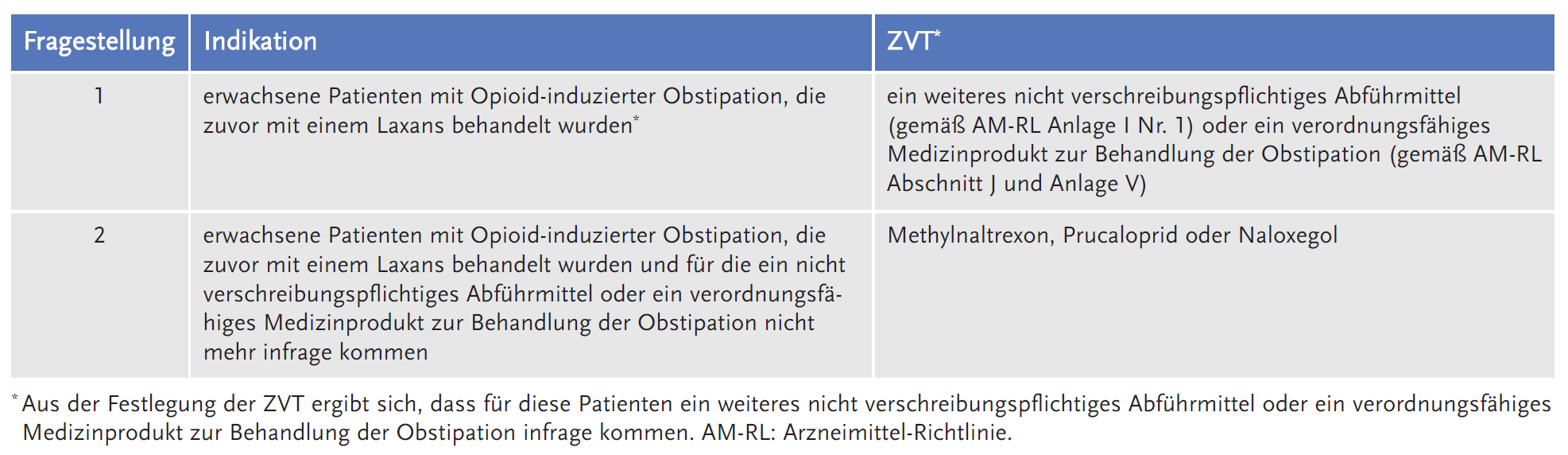
Vorgelegte Evidenz
Für die Nutzenbewertung legte der pharmazeutische Unternehmer (pU) keine Daten zum Vergleich mit der ZVT in der Fragestellung 1 vor. Für Fragestellung 2 wurde ein adjustierter indirekter Vergleich von Naldemedin gegenüber Naloxegol über den Brückenkomparator Standardtherapie vorgelegt. Dafür zog der pU die Studie COMPOSE-3 (1) heran, in der Naldemedin mit Placebo verglichen wurde, und die Studie KODIAC-08 (2), in der Naloxegol mit einer Standardtherapie verglichen wurde.
Dossierbewertung des IQWiG
Für das IQWiG war der vom pU vorgelegte adjustierte indirekte Vergleich nicht geeignet, Aussagen zum Zusatznutzen von Naldemedin gegenüber der ZVT treffen zu können (3). Dafür führte das IQWiG folgende Gründe an:
- Die Studie COMPOSE-3 lieferte Ergebnisse für eine Opioidtherapie nichttumorbedingter Schmerzen, die Fragestellungen der Dossierbewertung umfassen jedoch auch tumorbedingte Schmerzen.
- Aus der KODIAC-08-Studie entsprach nur eine Teilpopulation unbekannter Größe dem zugelassenen Anwendungsgebiet von Naldemedin und somit den Fragestellungen der vorliegenden Dossierbewertung, weil nur etwa zwei Drittel der Patienten mit Laxanzien vorbehandelt waren.
- Aufgrund der unterschiedlichen Laxanzientherapien in den Vergleichsarmen beider Studien bestand keine hinreichende Ähnlichkeit des Brückenkomparators. Die Voraussetzungen für einen adjustierten indirekten Vergleich waren nicht erfüllt.
- In der Studie KODIAC-08 wurde die Langzeitsicherheit von Naloxegol evaluiert, es wurden nur Endpunkte der Kategorie Nebenwirkungen erhoben. Der pU hat den indirekten Vergleich dementsprechend ausschließlich auf der Basis von UE-Endpunkten durchgeführt. Die Symptome der Opioid-induzierten Obstipation (insbesondere die intendierte Verbesserung der Symptomatik) wurden nicht erhoben, sodass eine Abwägung von Nutzen und Schaden nicht möglich war.
Stellungnahme der AkdÄ
Die AkdÄ stimmte der Dossierbewertung des IQWiG zu, dass aufgrund der unzureichenden Vergleichbarkeit der beiden Studien eine Aussage zu einem Zusatznutzen im Vergleich zur ZVT in der Fragestellung 2 nicht möglich ist. In beiden Studien gab es einen relevanten Anteil der Teilnehmer (ca. 30 %), die nicht mit einem Laxans vorbehandelt waren, die also für den vom pU angestrebten Vergleich nicht qualifiziert waren. Auch blieb unklar, in welchem Ausmaß bei den anderen Studienpatienten eine vorbestehende Laxanzientherapie unzureichend war, die also der Fragestellung 2 der ZVT entsprachen. Die Studie KODIAC-08 wählte UE als primären Endpunkt, nicht die Wirksamkeit. Eine Schaden-Nutzen-Bewertung war daher nicht möglich (4).
Nach der mündlichen Anhörung wurde das IQWiG vom G-BA mit einer ergänzenden Bewertung von im Stellungnahmeverfahren vorgelegten Daten beauftragt, um zu prüfen, ob eine Aufteilung der Patienten in der Zielpopulation entsprechend den beiden Fragestellungen 1 + 2 vorgenommen werden kann (5). Das daraufhin angefertigte Addendum des IQWiG kam zum Schluss, das eine Differenzierung der Zielpopulation gemäß den Vorgaben des G-BA in Patienten, für die ein nicht verschreibungspflichtiges Abführmittel oder ein verordnungsfähiges Medizinprodukt zur Behandlung der Obstipation infrage kommt (Fragestellung 1) oder nicht mehr infrage kommt (Fragestellung 2), auf Grundlage der Angaben in Modul 3 und Modul 5 des Dossiers nicht vorgenommen werden konnte.
Beschluss des G-BA
Der G-BA beschloss, dass ein Zusatznutzen von Naldemedin nicht belegt ist (Tabelle 1) (6).

Literatur
- Webster LR, Nalamachu S, Morlion B et al.: Long-term use of naldemedine in the treatment of opioidinduced constipation in patients with chronic noncancer pain: a randomized, double-blind, placebo-controlled phase 3 study. Pain 2018; 159: 987-994.
- Webster L, Chey WD, Tack J et al.: Randomised clinical trial: the long-term safety and tolerability of naloxegol in patients with pain and opioid-induced constipation. Aliment Pharmacol Ther 2014; 40: 771-779.
- IQWiG Dossierbewertung: www.iqwig.de/download/A20-45_Naldemedin_Nutzenbewertung-35a-SGB-V_V1-0_final.pdf.
- Stellungnahme der AkdÄ:https://www.akdae.de/Stellungnahmen/AMNOG/A-Z/Naldemedin/Naldemedin-EB.pdf
- IQWiG Addendum: www.iqwig.de/download/G20-23_Naldemedin_Addendum-zum-Auftrag-A20-45_V1-0.pdf.
- G-BA: Tragende Gründe: www.g-ba.de/downloads/40-268-7017/2020-11-05_AM-RL-XII_Naldemedin_D-512_TrG.pdf.
Hinweise
Arzneimittel, die mit einem schwarzen Dreieck (▼) gekennzeichnet sind, unterliegen einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden.
„Neue Arzneimittel“ ist eine Information der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) zu neu zugelassenen Arzneimitteln oder zu neu zugelassenen Indikationen. Ziel ist es, den Ärzten zeitnah Informationen zu diesen Arzneimitteln zur Verfügung zu stellen, zunächst bei Markteinführung sowie nach der frühen Nutzenbewertung durch den Gemeinsamen Bundesausschuss (G-BA) (§ 35a Absatz 1 SGB V). „Neue Arzneimittel“ bei Markteinführung enthält Informationen basierend auf dem Europäischen Öffentlichen Bewertungsbericht (EPAR) der Europäischen Arzneimittel-Agentur (EMA) sowie weiteren bei Markteinführung vorliegenden Daten aus klinischen Studien. Nach Abschluss der frühen Nutzenbewertung wird der Zusatznutzen des neuen Arzneimittels und seine therapeutische Bedeutung auf der Basis der Dossierbewertung des IQWiG, der Stellungnahme der AkdÄ und des Beschlusses des G-BA im Rahmen der frühen Nutzenbewertung dargestellt („Update – Neue Arzneimittel“).
vorab online
Dieser Artikel wurde am 7. Dezember 2020 vorab online veröffentlicht.
