Rheumatoide Arthritis (RA): frühe Diagnose und Therapie sind entscheidend
Zusammenfassung
Diagnostik und Therapie der Rheumatoiden Arthritis (RA) bleiben in Deutschland hinter den Anforderungen nationaler und internationaler Leitlinien und im Vergleich zum europäischen Ausland deutlich zurück. Dabei sind Kassifikationskriterien, Indikation und Durchführung der Therapie gut etabliert, sodass in den meisten Fällen auch der Nicht-Rheumatologe die Erkrankung erkennen kann. Frühzeitige Erkennung und unmittelbare Einleitung einer Basistherapie sind wesentlich zur Minimierung der RA-typischen Gelenkveränderungen und verbessern die Lebenserwartung. Die unter Beachtung von Kontraindikationen und Nebenwirkungen immer wieder zu modifizierende Therapie sollte durch einen internistischen Rheumatologen geführt werden.
Abstract
Diagnosis and treatment of rheumatoid arthritis (RA) in Germany has fallen behind the requirements of national and international guidelines and also in comparison to the rest of Europe. However, classification criteria, indication and conduction of treatment are well established, so that in most cases even non-rheumatologists can identify the disease. Early recognition and immediate start of basic treatment are essential for the minimization of RA-typical joint changes and improve life expectancy. The treatment should be managed by a rheumatologist, be performed under observation of contraindications and potential side-effects, and modified accordingly.
Jährlich erkranken in Deutschland ca. 300–500 Menschen je eine Million der Bevölkerung neu an einer rheumatoiden Arthritis (RA), das sind ca. 27.000 Neuerkrankungen pro Jahr. Die Prävalenz beträgt ca. 0,8 % der Erwachsenen, d. h. es leben gegenwärtig in Deutschland ca. 534.000 Menschen mit RA. Etwa Dreiviertel der Betroffenen sind Frauen im mittleren und höheren Lebensalter (1).
Ein wesentlicher Schwerpunkt im klinischen Alltag liegt auf der frühen Erkennung und Therapie. Nationale und internationale Leitlinien geben einen optimalen Zeitraum von zwölf Wochen bis zur Therapieeinleitung an („window of opportunity“). Schon ein relativ geringer zeitlicher Verzug bis zum Beginn der Therapie hat für das Outcome ungünstige Auswirkungen. Dies wurde in einer holländischen Studie mit 1674 Patienten gezeigt (2). 69 % der RA-Patienten wurden nicht innerhalb der erwünschten Zeit von zwölf Wochen vom Rheumatologen gesehen bzw. erhielten keine Therapie, im Median ergab sich bei ihnen eine Verzögerung von 18,4 Wochen. Diese vergleichsweise moderate Verzögerung führte bereits zu einer signifikanten Hazard Ratio von 1,87 für Nichterreichen einer DMARD(disease modifying antirheumatic drug)-freien Remission, außerdem über sechs Jahre zu einer um 1,3 erhöhten Rate an radiologischen Destruktionen, d. h. frühe Versäumnisse in der Therapie können über Jahre nicht mehr aufgeholt werden.
Die Empfehlungen der Deutschen Gesellschaft für Rheumatologie zum Management der frühen RA von 2011 fordern ebenfalls einen Therapiebeginn innerhalb der ersten zwölf Wochen nach Symptombeginn (3). In Deutschland erreichen dieses Ziel nach einer europäischen Vergleichsstudie derzeit nur 10 % der RA-Patienten, in anderen europäischen Ländern jedoch bis 50 % (4). 2012 betrug in Deutschland die mittlere Zeit vom Erstsymptom bis Überweisung zum Rheumatologen knapp ein Jahr (1).
Es ist deshalb ganz entscheidend, dass der Hausarzt mögliche RA-Zeichen erkennt und entsprechend reagiert. Jeder Patient mit RA sollte von einem internistischen Rheumatologen regelmäßig mitbetreut werden. Bei engmaschigen klinischen und serologischen Kontrollen und unter Berücksichtigung von Kontraindikationen kann die initiale Diagnostik und RA-Therapie auch durch einen Nicht-Rheumatologen erfolgen, um den Therapiebeginn durch Wartezeit auf einen Termin beim Rheumatologen nicht zu verzögern.
Diagnose: ACR-/EULAR-Klassifikationskriterien für die RA
Die 2010 in einer Kooperation der Amerikanischen Gesellschaft für Rheumatologie (ACR) und der Europäischen Fachgesellschaft (EULAR) revidierte RA-Klassifikation ermöglicht eine frühzeitige klinische Diagnose (siehe Abbildung 1) (5).
Die Überprüfung dieser Kriterien sollte bei jedem Patienten mit mindestens einem synovialitisch geschwollenen Gelenk nach Ausschluss anderer Ursachen (Trauma, Gicht oder andere Kristall-Arthropathie, aktivierte Arthrose, Psoriasis-Arthritis) erfolgen.

Die Kriterien wurden validiert an drei verschiedenen Kohorten mit früher RA (Leiden, Leeds und Toronto) mit einer Krankheitsdauer von weniger als zwölf Monaten. Der Anteil der Patienten mit 6/10 Punkten in diesen drei Kohorten war: 96,8 % / 90,5 % und 87,2 %.
Ein Vergleich mit den früheren ACR-Kriterien von 1987 konnte in der Tat zeigen, dass mit den neuen Klassifikationskriterien eine deutlich frühere Klassifikation einer Arthritis als RA gelingt.
Trotzdem kann es sich auch unterhalb der Sechs-Punkte-Schwelle um eine RA handeln. Unabhängig von diesen Kriterien sollte daher in typischen Konstellationen das Vorliegen einer RA geklärt und ggf. auch eine Therapie eingeleitet werden:
- mittleres Lebensalter, weibliches Geschlecht
- Arthritis in vielen kleinen Gelenken
- hoch positive CCP(cyclisches citrulliniertes Peptid)- bzw. MCV(mutiertes citrulliniertes Vimentin)-Antikörper
- Morgensteife von mehr als einer Stunde, insbesondere in den Händen und Füßen
Therapie
Für die Therapie der RA stehen aktuelle Empfehlungen der EULAR von 2013 zur Verfügung (6;7). Sofort bei Diagnose einer RA besteht die Indikation zu einer Basistherapie (=cs/nbDMARD: conventional syntethic/nicht biologische Therapie/disease modifying antirheumatic drug). Standard der Erstlinientherapie ist Methotrexat (MTX), einmal wöchentlich appliziert (am besten subkutan) in einer Dosierung zwischen 15 mg und 20 mg (6;7).
Der Einsatz von MTX erfordert eine normale Nierenfunktion. Es gibt zwar Empfehlungen, dass bei einer GFR < 60 ml/min abgestuft reduzierte MTX-Dosierungen möglich sind. Dies ist prinzipiell möglich, aber risikoreich und sollte in jedem Fall dem Rheumatologen überlassen bleiben. Weitere empfohlene Voruntersuchungen am Beginn einer MTX-Therapie sind neben der GFR: Blutbild, Leberwerte, die Untersuchung auf Vorliegen einer Hepatitis B und C, außerdem empfiehlt sich ein Röntgenhorax und eine Lungenfunktion (pulmonale Vorerkrankungen oder auch schon Hinweise auf RA-Beteiligung), auch ist eine abdominelle Sonographie sinnvoll. MTX ist teratogen, eine zuverlässige Antikonzeption ist nötig. Alkohol sollte gemieden werden, desgleichen eine Ko-Medikation mit Cotrimoxazol und NSAR.
Die Bioverfügbarkeit der oralen MTX-Applikation ist mit Dosierungen über 15 mg pro Woche nicht mehr wesentlich zu steigern, weshalb dann die subkutane Gabe zu bevorzugen ist (8). Bei der oralen Gabe ist auf die nahrungsgetrennte Einnahme zu achten. Unbestritten ist auch der Nutzen der Folsäure-Gabe am Folgetag zur signifikanten Reduktion von Nebenwirkungen der MTX-Therapie (insbesondere Leberwerterhöhung, Schleimhautveränderungen). In aller Regel reicht eine Dosis von 5–10 mg Folsäure oral am Folgetag.
Meist ist anfänglich bis zum MTX-Wirkungseintritt (sechs bis acht Wochen) die Kombination mit Prednisolon erforderlich, oft reichen initiale Dosierungen von Prednisolon 20 mg pro Tag aus. Sollten primäre Kontraindikationen (u. a. eingeschränkte Nierenfunktion, s. o.) gegen eine MTX-Therapie vorliegen, kann alternativ Leflunomid eingesetzt werden. Die Wirksamkeit der eingeleiteten Therapie ist engmaschig zu kontrollieren, Therapieziel ist die Remission („treat to target“). Zur Aktivitätsbeurteilung wird sowohl in klinischen Studien als auch in der alltäglichen Praxis der DAS 28 (disease activity score) herangezogen, er berücksichtigt Schmerzen und Schwellung von 28 Gelenken, den CRP- bzw. BSG-Wert und das Patientenurteil auf einer visuellen Analogskala (www.4s-dawn.com/DAS28/). Ein DAS < 2,6 wird als Remission betrachtet. Sollte dieses Ziel nicht spätestens nach drei Monaten erreicht werden, kann die MTX-Dosis bis 25 mg pro Woche (dann in jedem Fall s.c.) gesteigert werden.
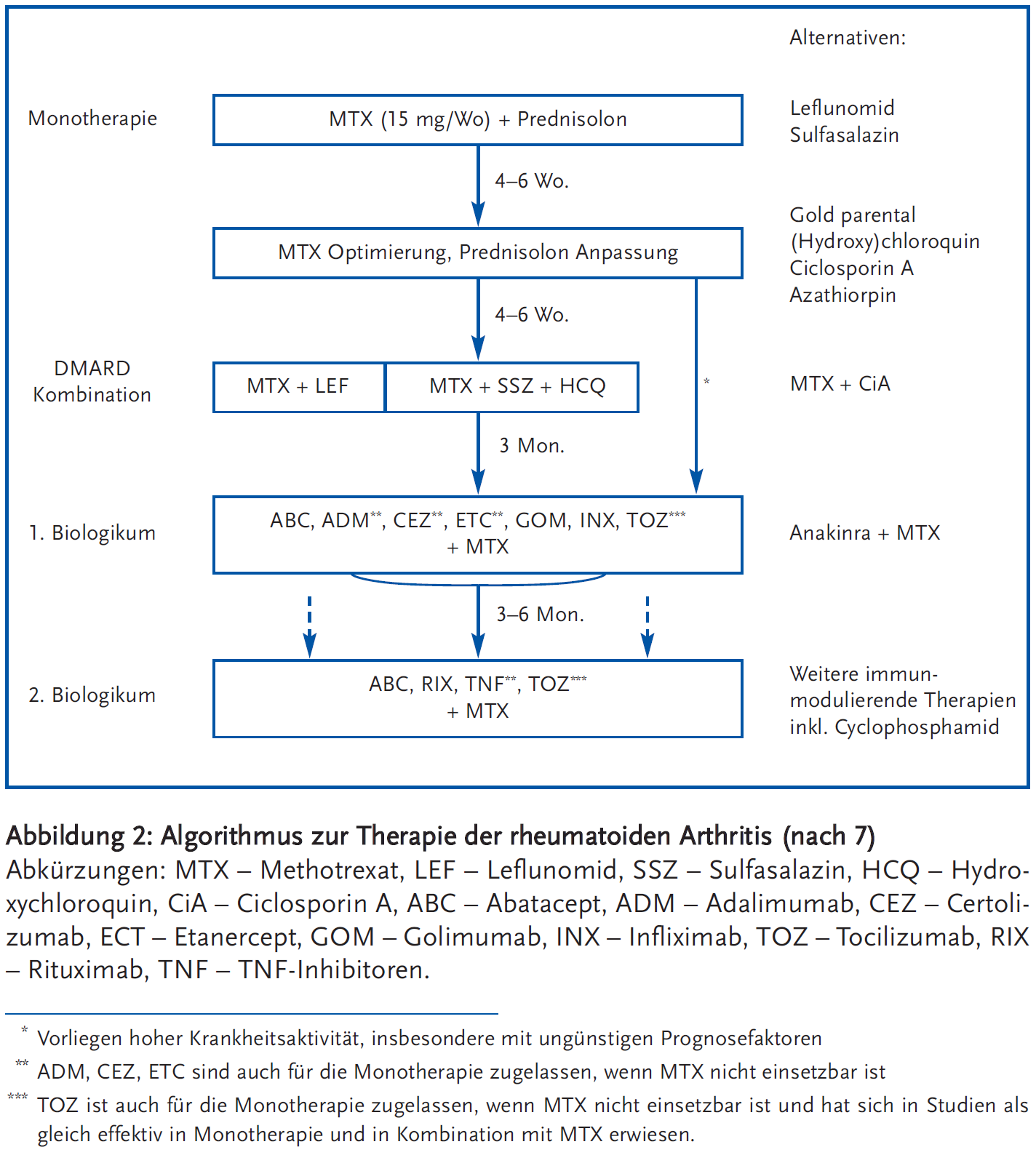
Bei fehlendem Ansprechen einer adäquaten MTX-Therapie gibt es mehrere Alternativen; zum einen die Addition von einem weiteren csDMARD (conventional synthetic DMARD), entweder additiv Leflunomid oder aber das sog. O`Dell-Schema (MTX + Sulfasalazin + Hydroxychloroquin). Bei der Kombination MTX + Leflunomid sind anfänglich sehr engmaschige Kontrollen der Leberwerte erforderlich (die ersten vier Wochen wöchentlich).
Alle anderen konventionellen DMARDs (Gold, Azathioprin, Cyclosporin A) haben keine praktische Bedeutung mehr, auch wenn sie weiterhin grundsätzlich anwendbar sind.
Bei sehr schweren Verläufen, hoher Aktivität und frühen Destruktionen kann auch bereits an dieser Stelle (in der Regel additiv zu MTX) ein Biologikum eingesetzt werden. Hier gibt es keine Priorisierung eines bestimmten Biologikums (bDMARD: bilogical Disease modifying Drug). Rituximab sollte allerdings nur bei speziellen Konstellationen als erstes Biologikum eingesetzt werden. Die Entscheidung zu einem Biologikum sollte immer durch einen internistischen Rheumatologen getroffen werden. Mit Ausnahme von Tocilizumab sollten alle anderen Biologika in Kombination mit MTX eingesetzt werden, die Kombination ist in allen Belangen den jeweiligen Einzeltherapien überlegen. In Deutschland beträgt die Krankheitsdauer bei Einsatz des ersten Biologikum noch immer im Durchschnitt zehn Jahre. Momentan stehen fünf Substanzen zur Verfügung die TNF-alpha blockieren, davon vier Antikörper und ein Fusionsprotein. Weitere Substanzen hemmen Interleukin 1 (Anakinra) oder Interleukin 6 (Tocilizumab). Rituximab führt zu einer B-Zell-Depletion und Abatacept zur Blockade der T-Zellaktivierung durch Antigen-präsentierende Zellen. Alle Biologika haben in kontrollierten Studien neben ihrer in aller Regel raschen und guten symptomatischen Wirkung eine hohe Potenz zur Verhinderung bzw. Verlangsamung von radiologischen Destruktionen gezeigt. Welches Biologikum dann letztlich zum Einsatz kommt hängt u. a. von Alter, von den Komorbiditäten und Applikationsform ab.
Das Prednisolon ist initial meist unverzichtbar, sollte aber nach den aktuellen EULAR-Empfehlungen möglichst nach sechs Monaten vollständig beendet werden; zur Symptomkontrolle kann es aber in Einzelfällen sinnvoll sein, eine niedrige Prednison-Dosis (< 5 mg pro Tag) zu belassen. Dabei ist zu beachten, dass bei älteren Patienten bereits die Einnahme von 5 mg pro Tag reichen, das Infektionsrisiko um über 50 % zu steigern.
Für alle synthetischen oder biologischen DMARDs sind zum einen regelmäßige Erfolgskontrollen („treat to target“) , z. B. mit dem DAS 28, als auch Medikamentenkontrollen nötig, letztere sind unter www.dgrh.de einzusehen.
Supportive Maßnahmen
Jede längerfristige Therapie mit Kortikosteroiden erfordert eine Substitution von Vitamin D (ggf. auch Calcium). Eine DXA(dual energy X-ray absortiometry)-Osteodensitometrie bei Krankheitsbeginn bzw. am Beginn einer längerfristigen Prednisolon-Therapie ist indiziert (und wird in dieser Indikation auch durch die gesetzlichen Krankenkassen finanziert). Nach den aktuellen Leitlinien des Dachverbands Osteologie e. V. (DVO) sollte ggf. eine spezifische Therapie, z. B. mit Bisphosphonaten erfolgen (ggf. Mitbetreuung durch Osteologen). Für alle Patienten mit immunsuppressiver Therapie sollten die STIKO-Impfempfehlungen berücksichtigt werden. Der Impfstatus ist in Deutschland noch sehr defizitär, so sind nur 19 % der RA-Patienten in Deutschland gegen Pneumokokken geimpft. Zu beachten ist bei Rituximab, dass Impfungen spätestens vier Wochen vor der Therapie erfolgen müssen, da später mit einem deutlich reduziertem oder gar fehlendem Impfansprechen gerechnet werden muss. Außerdem sollten unter Immunsuppression keine Lebendimpfstoffe zum Einsatz kommen.
Unter MTX und auch Leflunomid ist auf eine zuverlässige Kontrazeption zu achten.
Outcome
In der Vergangenheit hatten RA-Patienten eine deutliche Übersterblichkeit bzw. reduzierte Lebenserwartung von 10−15 Jahren. Als Hauptursache ist neben einem deutlich erhöhten Lymphom-Risiko die akzeleriert verlaufende Arteriosklerose zu nennen. Zahlreiche Untersuchungen haben für RA-Patienten ein deutlich erhöhtes kardiovaskuläres Risiko gezeigt, das unabhängig ist von anderen Risikofaktoren (9). Kardiovaskuläre Ereignisse treten bereits in den ersten vier RA-Krankheitsjahren signifikant gehäuft auf. Patienten mit Rheumatoider Arthritis haben ein vergleichbares kardiovaskuläres Risiko wie Patienten mit Diabetes mellitus Typ 2. Eine erfolgreiche Therapie der RA ist entscheidend für die Risikoreduktion (10;11). Ein regelmäßiges Screening auf das Vorliegen von zusätzlichen kardiovaskulären Risikofaktoren ist nötig mit entsprechenden Interventionen.
In den letzten Jahren konnte eine deutliche Verbesserung der Lebenserwartung gezeigt werden. Hier ist in erster Linie die bessere Krankheitskontrolle zu nennen. Wie wichtig das Erreichen einer Remission für die Lebenserwartung ist, haben neue Untersuchungen gezeigt. Patienten, die in den ersten fünf Jahren keine Remission erreichen, haben eine doppelt so hohe Mortalität im Vergleich zu Patienten, die dieses Ziel frühzeitig erreichen. Daten aus dem deutschen Biologika-Register RABBIT (Einschluss von Patienten mit Biologika im Vergleich zu Patienten mit konventionellen Basistherapien) haben gezeigt, dass Patienten mit einem DAS 28 > 5,1 (hohe Aktivität) immer noch eine Lebensverkürzung von zehn Jahren haben (12).
Wahrscheinlich reduzieren Biologika die Mortalität noch besser als csDMARDs. Unabhängig von der dafür eingesetzten Therapiestrategie (csDMARD vs. bDMARD) ist im klinischen Alltag jedoch das rasche Erreichen einer Remission entscheidend.
Für das Erreichen einer Remission sind fortlaufend engmaschige Kontrollen nötig bzw. immer wieder Therapieanpassungen („tight control“). In der Therapieeinleitungsphase führen Kontrollen alle vier Wochen zu einem deutlich höheren Anteil an Patienten mit Remission im Vergleich zu dreimonatigen Kontrollintervallen (13). Die einmal eingeleitete DMARD-Therapie ist also kein „Ruhekissen“!
Fazit für die Praxis
Die Diagnose einer RA erfordert den raschen Beginn einer krankheitsmodulierenden DMARD-Therapie, möglichst innerhalb der ersten drei Monate. Bei fehlenden Kontraindikationen (Voraussetzung: normale Nierenfunktion) ist das Mittel der ersten Wahl Methotrexat 15–20 mg/Woche, bevorzugt subkutan appliziert. Das Therapieziel ist die Remission (DAS 28 < 2,6). Bei Nichterreichen einer Remission nach drei Monaten kann die Kombination mit einem weiteren csDMARD sinnvoll sein oder aber bei hochfloridem und frühzeitig destruierendem Verlauf die Kombination mit einem Biologikum. Unter allen Therapien sind regelmäßige (mindestens alle drei Monate) rheumatologische Kontrollen nötig, außerdem medikamentenbezogene Kontrollen (www.dgrh.de/Start/Versorgung/Therapie%C3%BCberwachung/Therapie%C3%BCberwachungsb%C3%B6gen.html). RA-Patienten haben frühzeitig im Krankheitsverlauf ein deutlich erhöhtes kardiovaskuläres Risiko, vergleichbar mit Patienten mit einem Diabetes mellitus Typ 2: Ein gleiches Risikomanagement ist erforderlich.
Interessenkonflikte
Ein Interessenkonflikt wird von der Autorin verneint.
Literatur
- Zink A: Versorgung Rheumatologie. Z Rheumatol 2014; 73: 115-122.
- Van der Linden MPM, Le Cessie S, Raza K et al. Long-term Impact of Delay in Assessment of Patients With Early Arthritis. Arthritis Rheum 2010; 62: 3537- 3546.
- Schneider M. Lelgemann H.-H, Abholz M, et al. Interdisziplinäre Leitlinie: Management der frühen rheumatoiden Arthritis.3. Aufl., Berlin, Heidelberg, New York: Springer-Verlag, 2011.
- Raza K, Stack R, Kumar K, et al. Delays in assessment of patients with rheumatoid arthritis: variations across Europe. Ann Rheum Dis. 2011; 70: 1822-1825.
- Aletaha D, Neogi T, Silman AJ, et al. 2010 Rheumatoid arthritis classification criteria: An American College of Rheumatology/European League Against Rheumatism collaborative initiative. Ann Rheum Dis 2010: 69: 1580-1588.
- Smolen JS, Landewe R, Breedveld C, et al. EULAR recommendation for the management of rheumatoid arthritis with synthetic and biological disease modifying antirheumatic drags: 2013 update. Ann Rheum Dis 2014: 73: 492-509.
- Krüger K, Wollenhaupt J, Albrecht K, et al. S1-Leitlinie der DGRh zur sequenziellen medikamentösen Therapie der rheumatoiden Arthritis 2012. Adaptierte EULAR-Empfehlungen und aktualisierter Therapie-Algorhythmus. Z Rheumatol 2012; 71: 592-603.
- Schiff MH, Jaffe JS, Freundlich B. Head-to-head randomised, crossover study of oral vs. subcutaneous methotrexate in patient with rheumatoid arthritis: drug exposure limitations of oral methotrexate at doses > 15mg may be overcome with subcutaneous administration. Ann Rheum Dis 2014; 73: 1549-1551.
- Holmqvist ME, Wedren S, Jacobsson LTH et al. Rapid increase in myocardial infarction risk following diagnosis of rheumatoid arthritis amongst patients diagnosed between 1995 and 2006. J Int Med 2010; 268: 578-585.
- Peters MJL, van Halm VP, Voskuyl AE et al. Does rheumatoid arthritis equal diabetes mellitus as an independent risk factor for cardiovascular disease? A prospective study. Arthritis Care Res 2009; 61: 1571-1579.
- van Halm VP, Peters MJL, Voskuyl AE et al. Rheumatoid arthritis versus diabetes as a risk factor for cardiovascular disease: a cross-sectional study, the CARRÉ Investigation. Ann Rheum Dis 2009; 68: 1395-1400.
- Listing J, Kekow J, Manger B, et al. Mortality in rheumatoid arthritis: the impact of disease activity, treatment with glucocorticoids, TNFalpha inhibitors and rituximab. Ann Rheum Dis. 2015; 74: 415-421.
- Schipper LG, Vermeer M, Kuper HH, et al. A tight control treatment strategy aiming for remission in early rheumatoid arthritis is more effective than usual care treatment in daily clinical practice: a study of two cohorts in the Dutch Rheumatoid Arthritis Monitoring registry. Ann Rheum Dis 2012; 71: 845-850.
