Ertugliflozin/Sitagliptin (Steglujan®) ▼
Zugelassene Indikation und Wirkmechanismus
Ertugliflozin/Sitagliptin (Steglujan®) ist zugelassen als Ergänzung zu Diät und Bewegung zur Verbesserung der Blutzuckerkontrolle bei Patienten ab dem 18. Lebensjahr mit Diabetes mellitus Typ 2 (DMT2):
- deren Blutzucker unter Metformin und/oder einem Sulfonylharnstoff und einem der in Steglujan® enthaltenen Einzelwirkstoffe nicht ausreichend gesenkt werden kann;
- die bereits mit der Kombination aus Ertugliflozin und Sitagliptin in Form von einzelnen Tabletten behandelt werden.
Ertugliflozin ist ein Natrium-Glukose-Cotransporter-2-(SGLT-2)-Inhibitor. Durch die selektive und reversible Hemmung von SGLT-2 wird die Rückresorption von glomerulär filtrierter Glukose reduziert und die sogenannte Nierenschwelle für Glukose gesenkt, sodass die Glukoseausscheidung im Urin steigt.
Sitagliptin ist ein Dipeptidyl-Peptidase-4-(DDP-4)- Inhibitor, der den Abbau der Inkretinhormone Glucagon-like Peptid 1 (GLP-1) und Glucose-dependent insulinotropic Peptid (GIP) im Körper blockiert und dadurch ihre Plasmaspiegel erhöht. Zusätzlich unterdrückt Sitagliptin die Glukagonsekretion und führt darüber zu einer Hemmung der hepatischen Glukoseproduktion.
Markteinführung
Steglujan® (Ertugliflozin/Sitagliptin) ist seit dem 15. Mai 2018 in dieser Indikation auf dem deutschen Arzneimittelmarkt.
Bewertung
Steglujan® (Ertugliflozin/Sitagliptin) ist eine Fixkombination aus dem vierten zugelassenen SGLT-2-Inhibitor Ertugliflozin und dem DDP-4-Hemmer Sitagliptin. In den Zulassungsstudien senkte diese Fixkombination HbA1c, Körpergewicht und Blutdruck signifikant stärker als Placebo in der Initialtherapie sowie als Add-on zu Metformin. Diese signifikante Senkung wurde auch im Vergleich zur Therapie mit Sitagliptin bzw. Ertugliflozin allein als Add-on zu Metformin gezeigt. Dabei war die Senkung von Körpergewicht und Blutdruck im Vergleich zur Ertugliflozin allein nicht signifikant verschieden und numerisch sogar kleiner.
Ob sich diese Effekte im eigentlichen Therapieziel, der Verringerung diabetischer Folgekomplikationen, niederschlagen, ist offen, weil Endpunktstudien dazu bisher fehlen, ebenso wie Studien zu Effekten auf kardiovaskuläre Erkrankungen. Für die Fixkombination mit Sitagliptin ist der Beleg der positiven Beeinflussung der kardiovaskulären Morbidität und Mortalität besonders wichtig, da auch für Sitagliptin alleine dieser Nachweis nicht erbracht worden ist.1 Die vergleichende Wirksamkeit mit anderen oralen Antidiabetika wurde weder in der Monotherapie noch in der Kombinationstherapie – mit Ausnahme der Add-on-Gabe zu Metformin – genügend untersucht.
Ertugliflozin bewirkt eine osmotische Diurese und Glukosurie. Dies kann zu Volumenmangel und symptomatischer Hypotonie insbesondere bei Patienten mit eingeschränkter Nierenfunktion, bei älteren Patienten und bei gleichzeitiger Einnahme von Diuretika oder Antihypertonika führen. Unter der Einnahme von Ertugliflozin traten in klinischen Studien sehr häufig genitale Pilzinfektionen auf. Die Wirksamkeit von Ertugliflozin verringert sich mit abnehmender Nierenfunktion und bleibt bei Patienten mit schwerer Einschränkung der Nierenfunktion aus. Eine Behandlung von Patienten mit eGFR unter 60 ml/min/1,73 m2 sollte nicht begonnen werden.
Ertugliflozin/Sitagliptin kommt gemäß Zulassung nur in Frage, wenn unter Metformin und/oder einem Sulfonylharnstoff, Ertugliflozin oder Sitagliptin keine ausreichende Blutzuckerkontrolle erreicht wurde. Insgesamt erscheint der Einsatz der Fixkombination allenfalls nachrangig – und nur bei normaler Nierenfunktion gerechtfertigt. Weiterhin bestehen offene Fragen bezüglich der Anwendung bei älteren Patienten (≥ 75 Jahre) und bei Patienten mit Herzinsuffizienz der NYHA Klasse II–IV sowie bezüglich der kardiovaskulären Langzeitsicherheit von Ertugliflozin, die aktuell keine abschließende Bewertung des Nutzen-Risiko-Profils zulassen.
Wirksamkeit in den Zulassungsstudien
Für die Zulassung reichte der pharmazeutische Unternehmer die Ergebnisse aus drei multizentrischen, randomisierten, doppelblinden, placebo- oder aktiv kontrollierten, Phase-III-Studien an insgesamt 1985 Patienten mit DMT2 ein. Untersucht wurden die Wirksamkeit und Sicherheit von Ertugliflozin 5 mg bzw. 15 mg in Kombination mit 100 mg Sitagliptin als initiale Therapie und auch als Add-on zu Metformin im Vergleich zu Placebo und im Vergleich zu Ertugliflozin bzw. Sitagliptin allein als Add-on zu Metformin. Primärer Endpunkt war die Senkung des HbA1c-Wertes. Als sekundäre Endpunkte wurden u. a. die Änderung des Körpergewichts und des systolischen Blutdrucks erhoben. In den einzelnen Studien zeigte die Kombination Ertugliflozin/Sitagliptin eine signifikant stärkere Senkung des HbA1c-Wertes im Vergleich zu Placebo in der Initialtherapie und als Add-on zu Metformin. Dieser Effekt wurde auch für die Kombination im Vergleich zu Ertugliflozin oder Sitagliptin allein als Add-on zu Metformin gezeigt (siehe Tabelle 1).
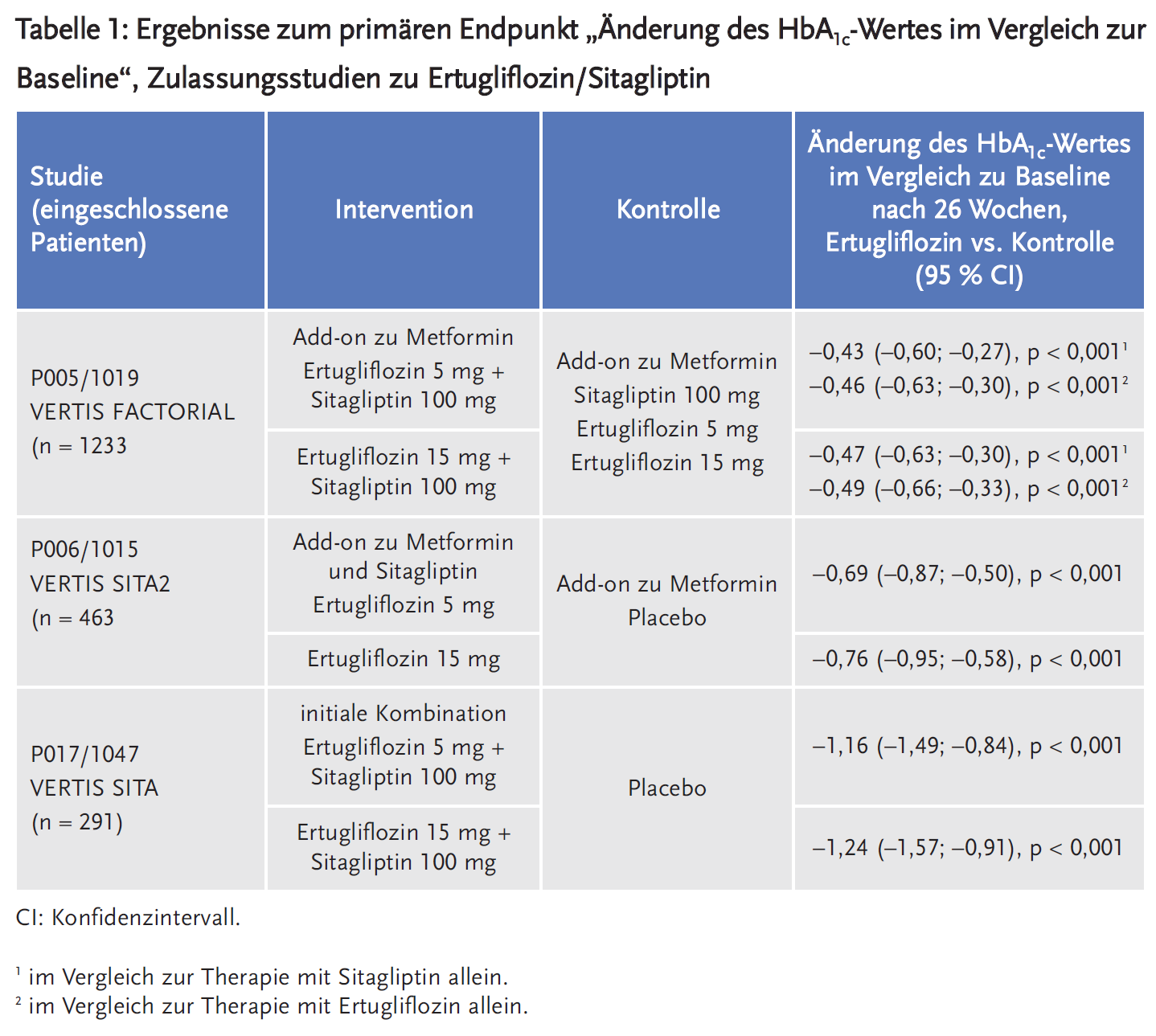
Auch bezüglich der sekundären Endpunkte waren die Ergebnisse unter Ertugliflozin/Sitagliptin signifikant besser. Nach 26 Wochen zeigte sich eine statistisch signifikante Senkung des systolischen Blutdrucks im Vergleich zu Sitagliptin alleine (–2,8 mmHg bzw. –3,0 mmHg für Ertugliflozin/Sitagliptin 5 mg/100 mg bzw. 15 mg/100 mg) oder im Vergleich zu Placebo (–4,4 mmHg bzw. –6,4 mmHg für Ertugliflozin/Sitagliptin 5 mg/100 mg bzw. 15 mg/100 mg). Im Vergleich zu Ertugliflozin allein zeigte sich kein Unterschied in der Senkung des systolischen Blutdrucks. Die mittlere Senkung des Körpergewichts in Differenz zu Sitagliptin allein lag bei 1,9 bzw. 2,3 kg unter Ertugliflozin 5 mg/Sitagliptin bzw. Ertugliflozin 15 mg/Sitagliptin. Im Vergleich zu Ertugliflozin allein zeigte sich diesbezüglich kein statistisch signifikanter Unterschied.
Als Add-on zu einer Hintergrundtherapie mit Metformin und Sitagliptin führte Ertugliflozin 5 mg bzw. 15 mg zu einer statistisch signifikanten Senkung des systolischen Blutdrucks in Differenz zu Placebo von 2,9 mmHg bzw. 3,9 mmHg sowie zu einer statistisch signifikanten Senkung des Körpergewichts in Differenz zu Placebo von 2,0 kg bzw. 1,7 kg. In der placebokontrollierten Studie zur Initialtherapie mit Ertugliflozin 5 mg bzw. 15 mg/Sitagliptin 100 mg betrug die statistisch signifikante Differenz in der Senkung des systolischen Blutdrucks im Vergleich zu Placebo 4,4 mmHg bzw. 6,4 mmHg, die statistisch signifikante Differenz in der Senkung des Körpergewichts 2,0 kg bzw. 2,1 kg.
Ausgewählte Nebenwirkungen
Die wichtigsten häufigen Nebenwirkungen waren Hypoglykämie, vulvovaginale Pilzinfektion, Harnwegsinfektionen, Candida-Balanitis sowie andere genitale Pilzinfektionen, vulvovaginaler Pruritus, Hypovolämie, erhöhter Harndrang, Durst und Anstieg der Serumlipide und des Hämoglobins. Im Vergleich zu Placebo (gepoolte Ergebnisse) war die Inzidenz von Hypoglykämien unter Ertugliflozin 5 mg und 15mg (5,0 % und 4,5 % versus 2,9 % unter Placebo) erhöht. In der Monotherapie zeigte sich ein nicht dosisabhängiger Anstieg hypoglykämischer Ereignisse unter Ertugliflozin (je 2,6 % für beide Dosierungen) im Vergleich zu Placebo (0,7 %). In der Add-on-Gabe zu Metformin war die Hypoglykämie-Inzidenz unter Ertugliflozin 5 mg (7,2 %) und Ertugliflozin 15 mg (7,8 %) deutlich erhöht im Vergleich zu Placebo (4,3 %). Renale Nebenwirkungen (z. B. akute Nierenschädigung, eingeschränkte Nierenfunktion, akute prärenale Insuffizienz) traten insbesondere bei Patienten mit moderater Einschränkung der Nierenfunktion auf. Schwerwiegende Nebenwirkungen waren diabetische Ketoazidosen und Überempfindlichkeitsreaktionen. In allen Studien gab es drei Ketoazidose-Fälle unter Ertugliflozin (keine Fälle in den Kontrollarmen).
Ausgewählte Warnhinweise
- Überprüfung der Nierenfunktion vor Beginn der Behandlung und in regelmäßigen Abständen danach empfohlen.
- Bei Patienten mit eGFR unter < 60 ml/min/1,73 m2 sollte eine Behandlung mit Ertugliflozin/Sitagliptin nicht begonnen werden.
- Bei einer eGFR unter 45 ml/min/1,73m2 sollte die Behandlung mit Ertugliflozin/Sitagliptin abgebrochen werden.
- Unter der Anwendung von Sitagliptin ist das Risiko für die Entwicklung einer akuten Pankreatitis erhöht. Nach Absetzen von Sitagliptin wurde ein Abklingen der Beschwerden beobachtet, es traten aber auch sehr seltene schwerwiegende Fälle nekrotisierender oder hämorrhagischer Pankreatitis und/oder Todesfälle auf. Die Patienten sollten auf anhaltende starke Bauchschmerzen als charakteristisches Symptom einer akuten Pankreatitis hingewiesen werden. Bei Verdacht auf eine Pankreatitis müssen Ertugliflozin/Sitagliptin sowie andere potenziell Pankreatitis verursachende Arzneimittel abgesetzt werden. Bei bestätigter akuter Pankreatitis ist die Therapie mit Ertugliflozin/Sitagliptin nicht wieder aufzunehmen. Bei Patienten mit einer Pankreatitis in der Krankengeschichte ist Vorsicht geboten.
- Aufgrund der osmotischen Diurese kann eine symptomatische Hypotonie nach Beginn der Behandlung insbesondere bei Patienten mit eingeschränkter Nierenfunktion (eGFR unter 60 ml/min/1,73 m2, bei älteren Patienten (≥ 65 Jahre), bei gleichzeitiger Einnahme von Diuretika oder bei Patienten unter Antihypertonika mit einer Hypotonie in der Vorgeschichte auftreten. Vor Beginn der Behandlung sollte der Volumenstatus überprüft und ggf. korrigiert werden. Die Patienten sind hinsichtlich Anzeichen und Symptome einer Hypotonie/Hypovolämie sowie hinsichtlich Volumenstatus und Elektrolytwerte nach Therapiebeginn zu überwachen, insbesondere im Falle von Erkrankungen, die zu einem Flüssigkeitsverlust führen können (z. B. gastrointestinale Erkrankungen).
- Bei Hospitalisierungen aufgrund größerer chirurgischer Eingriffe oder einer akuten schweren Krankheit ist die Behandlung mit Ertugliflozin zu unterbrechen.
- Unter der Therapie mit SGLT-2-Inhibitoren können diabetische Ketoazidosen auftreten. Unter Ertugliflozin zeigte sich in einer Reihe von Fällen ein untypisches Krankheitsbild mit nur mäßig erhöhtem Blutzuckerspiegel unter 250 mg/dl (14 mmol/l). Das Risiko einer diabetischen Ketoazidose muss beim Auftreten unspezifischer Symptomen wie Übelkeit, Erbrechen, Anorexie, Bauchschmerzen, übermäßigem Durst, Schwierigkeiten beim Atmen, Verwirrtheit, ungewöhnlicher Müdigkeit oder Schläfrigkeit in Betracht gezogen werden.
- Ertugliflozin kann aufgrund der osmotischen Diurese zu einem Anstieg des Serumkreatinins und einer Abnahme der eGFR führen, die insbesondere bei Patienten mit moderater Einschränkung der Nierenfunktion stärker ausgeprägt sind.
- Unter der Therapie mit einem anderen SGLT-2-Inhibitor wurde in klinischen Langzeitstudien eine erhöhte Anzahl von Amputationen der unteren Gliedmaßen (v. a. Zehen) beobachtet. Es ist nicht klar, ob dies ein Klasseneffekt darstellt, unter Ertugliflozin betrug die Häufigkeit der nicht traumabedingten Amputationen 0,3 %, in den Kontrollgruppen 0,1 %. Diabetes-Patienten sollen hinsichtlich der regelmäßigen präventiven Fußpflege beraten werden.
- Ertugliflozin erhöht das Risiko für genitale Pilzinfektionen, insbesondere bei Patienten mit Pilzinfektionen in der Vorgeschichte und bei Männern ohne Beschneidung. Diese Patienten sollten entsprechend überwacht und ggf. behandelt werden. Die erhöhte renale Glucoseausscheidung kann mit einem erhöhten Risiko für Harnwegsinfektionen einhergehen. Die Häufigkeit der Harnwegsinfektionen war in klinischen Studien unter Ertugliflozin 5 mg und 15 mg (4,0 % und 4,1 %) sowie unter Placebogruppe (3,9 %) nicht signifikant unterschiedlich. Bei der Behandlung einer Pyelonephritis oder einer Urosepsis sollte eine zeitweise Unterbrechung der Behandlung mit Ertugliflozin in Betracht gezogen werden.
- Aufgrund des Wirkmechanismus fallen Urintests auf Glucose bei mit Ertugliflozin behandelten Patienten positiv aus. Zur Blutzuckerselbstkontrolle sollten andere Methoden angewendet werden.

Weiterführende Informationen
Das IQWiG wurde am 15.05.2018 mit der Bewertung des Zusatznutzens beauftragt, über den der G-BA entscheiden wird. Sollte sich die AkdÄ mit einer Stellungnahme äußern, wird diese auf der AkdÄ-Website veröffentlicht.
Quelle
Europäischer Öffentlicher Beurteilungsbericht (EPAR) Steglujan®, erschienen am 5. April 2018. Die vorliegende Information erhebt keinen Anspruch auf Vollständigkeit. Für die Richtigkeit der angegebenen Dosierungen kann keine Gewähr übernommen werden.
Hinweise
Arzneimittel, die mit einem schwarzen Dreieck (▼) gekennzeichnet sind, unterliegen einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden.).
„Neue Arzneimittel“ ist eine Information der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) zu neu zugelassenen Arzneimitteln oder zu neu zugelassenen Indikationen. Ziel ist es, den Ärzten zeitnah Informationen zu diesen Arzneimitteln zur Verfügung zu stellen, zunächst bei Markteinführung sowie nach der frühen Nutzenbewertung durch den Gemeinsamen Bundesausschuss (G-BA) (§ 35a Absatz 1 SGB V). „Neue Arzneimittel“ bei Markteinführung enthält Informationen basierend auf dem Europäischen Öffentlichen Bewertungsbericht (EPAR) der Europäischen Arzneimittel-Agentur (EMA) sowie weiteren bei Markteinführung vorliegenden Daten aus klinischen Studien. Nach Abschluss der frühen Nutzenbewertung wird der Zusatznutzen des neuen Arzneimittels und seine therapeutische Bedeutung auf der Basis der Dossierbewertung des IQWiG, der Stellungnahme der AkdÄ und des Beschlusses des G-BA im Rahmen der frühen Nutzenbewertung dargestellt („Update – Neue Arzneimittel“).
Fußnoten
Der Wirkstoff liegt als Cokristall mit Pidolsäure (1:1) vor.
1Green JB, Bethel MA, Armstrong PW et al.; TECOS Study Group: Effect of sitagliptin on cardiovascular outcomes in type 2 diabetes. N Engl J Med 2015; 373: 232-242.
vorab online
Dieser Artikel wurde am 21. Juni 2018 vorab online veröffentlicht.
