Differenzialdiagnostik und -therapie des männlichen Hypogonadismus
Zusammenfassung
Die vorliegende Arbeit gibt einen kurzen Überblick über Definition, Epidemiologie, Pathophysiologie, Symptome und mögliche Therapien des Hypogonadismus.
Definition/Epidemiologie
Ein Hypogonadismus (ICD 10: E29.1) bedeutet ein Defizit der Hodenfunktion, also eine mangelhafte Testosteronsekretion oder/und eine gestörte Spermienproduktion.
Für Fertilitätsstörungen wird in Deutschland eine Häufigkeit von 5–7 % angegeben, wobei ein Testosteronmangel parallel nur in < 10 % der Fälle zu finden ist. Dies zeigt, dass grundsätzlich die Leydigzell-Funktion (Testosteronproduktion) im Vergleich zur Sertolizell-Funktion (Fertilität) gegenüber exogenen und endogenen Störungen robuster ist.
Klassifikation/Pathophysiologie
Bei den ursächlichen Krankheitsbildern unterscheiden wir zwischen primären Hypogonadismus (= hypergonadotroper Hypogonadismus; Abbildung 1A; Tabelle 1), sekundären Hypogonadismus (= hypogonadotroper Hypogonadismus; Abbildung 1B; Tabelle 1) und funktionellem Hypogonadismus (= normogonadotroper Hypogonadismus; Abbildung 1C; Tabelle 1).


In der alltäglichen andrologischen Abklärung entsprechender klinischer und laborchemischer Befunde finden wir die „klassischen“ Hypogonadismus-Ursachen (primärer und sekundärer) in maximal 5 % der Fälle (Abbildung 1A, 1B; Tabelle 1). Bei diesen Patienten ist die Testosterontherapie mit hoher Evidenz in ihrer Effektivität belegt und sollte bei fehlenden Kontraindikationen lebenslang durchgeführt werden (1-3).
Im Großteil der Fälle sind wir heute klinisch mit der Konstellation eines funktionellen Hypogonadismus konfrontiert. Hier ist die Testosteronerniedrigung Folge der entsprechenden Erkrankung bzw. des entsprechenden Einflussfaktors, sodass zunächst überlegt werden soll, ob der endogene Testosteronwert nicht durch Behandlung der entsprechenden Erkrankung bzw. Veränderung des Einflussfaktors normalisiert werden kann. Sehr wichtige klinische Ursachen sind dabei das metabolische Syndrom, die Depression und psychische und physische Überlastungssituationen (z. B. auch im Leistungssport).
Häufig werden diese Zusammenhänge auch beim Altershypogonadismus nicht beachtet: der physiologische Abfall des Testosterons im Alter kann durch Beachten der beeinflussbaren Faktoren minimiert werden, sodass dadurch die Indikation zur Testosterontherapie im Alter reduziert werden kann.
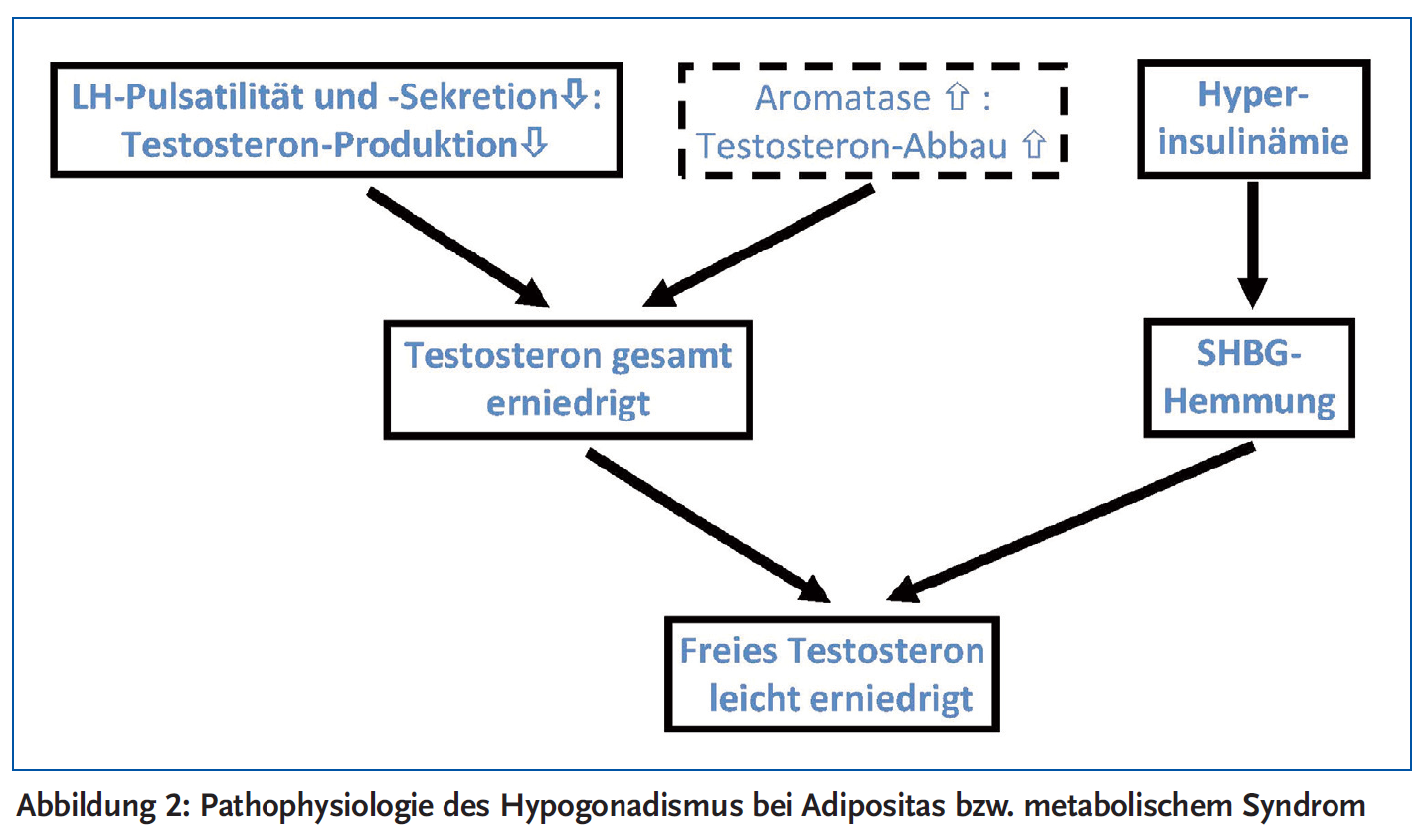
In den meisten Fällen ist die Bestimmung des Gesamt-Testosterons ausreichend, um die laborchemische Diagnose des Hypogonadismus zu stellen. Da es klinische Situationen mit erheblichen Beeinflussungen des Sexualhormon-bindenden Globulins (SHBG) gibt (Tabelle 2), ist in manchen Situationen die zusätzliche Betrachtung des freien bzw. bioverfügbaren Testosterons sinnvoll.

Insbesondere in der Pathophysiologie des funktionellen Hypogonadismus bei Adipositas/metabolischem Syndrom (Abbildung 2) ist die Beachtung dieses Zusammenhangs von wichtiger klinischer Bedeutung.
Klinisches Bild/Differenzialdiagnose
Die Symptome eines Hypogonadismus (Tabelle 3) sind mannigfaltig aber auch unspezifisch. Häufig kommen die Patienten über im Internet gefundene Symptomscores (z. B. „AMS (Aging Male Scala)-Bogen nach Heinemann“) mit der selbst gestellten Verdachtsdiagnose eines Testosteronmangels zu uns. Nicht selten werden auch niedrig gemessene Testosteronwerte mitgebracht, sodass der Patient mit hohen Erwartungshaltungen bezgl. des Rettungsanker Testosteron zu uns kommt. Hier müssen wir uns (und dem Patienten) klar machen, dass ein Patient mit Depression und/oder Adipositas per se auch zahlreiche unspezifische Symptome (Tabelle 3) berichtet und daher auch einen entsprechend hohen Symptomscore abliefern kann.
Der bei diesen Patienten (funktioneller Hypogonadismus, Abbildung 1C) dann häufig niedrig gemessene Testosteronwert ist oft nur ein Biomarker dieser Erkrankungen, sodass die alleinige pharmakologische Anhebung des Testosterons für diese Patienten auch nur selten eine nachhaltige klinische Besserung bewirkt.
Bei diesen Patienten ist das initiale Gespräch mit Aufklärung und auch Zuweisung des Patienten zu anderen Therapiemaßnahmen (medikamentöse Unterstützung bezüglich Gewichtsabnahme, Ernährungs- und Bewegungstherapie) aufwendig, aber dringlich und nachhaltig.
Durch die körperliche Untersuchung (Hodengröße etc.) und die laborchemische Diagnostik (Prolaktin, LH, Testosteron; unklare Anämie) sind die Fälle mit primären und sekundärem Hypogonadismus (Abbildung 1A, 1B; Tabelle 1), bei denen bei Fehlen von Kontraindikationen eine klare Indikation zur Substitution mit Testosteron besteht, klar zu differenzieren.

Laborchemische Diagnostik
In der initialen Diagnostik ist die morgendliche Bestimmung des Gesamt-Testosterons (Abbildung 3) ausreichend. Liegt dieser Wert über 12 nmol/l (3,5 ng/ml), ist meistens eine weitere Diagnostik nicht notwendig. Besteht allerdings klinisch ein Verdacht auf eine komplexere endokrinologische Erkrankung (Tabelle 1), so sind hier selten dennoch zusätzliche andrologische Parameter (Inhibin, LH, FSH, SHBG; Abb. 1A, B) und andere endokrinologische Parameter (Cortisol; TSH, fT3, fT4; IGF-1; Prolaktin; Abbildung 1B) zu bestimmen.
Ein morgendlicher Gesamt-Testosteronwert unter 12 nmol/l (3,5 ng/ml) sollte kontrolliert werden (Abbildung 3) inklusive zusätzlicher Bestimmung von LH, Prolaktin, SHBG. Bei zweimaliger morgendlicher Bestimmung eines Gesamt-Testosterons < 8 nmol/l (2,3 ng/ml) ist die Diagnose Hypogonadismus belegt, im Graubereich 8–12 nmol/l (2,3–3,5 ng/ml) soll der freie Testosteronwert mitberücksichtigt werden. Hierbei ist das freie berechnete Testosteron (http://www.issam.ch/freetesto.htm) die einzige valide Methode, Assays zur Bestimmung des freien Testosterons und auch der freie Androgenindex (FAI) sind diesbezüglich obsolet.
Auch für das freie Testosteron wird ein Graubereich zwischen 180–220 pmol/l (52–64 pg/ml) angegeben. Wir haben uns bewusst für den niedrigeren Cut-off entschieden, um bei der ohnehin häufigen Verdachtsdiagnose des funktionellen Hypogonadismus möglichst den zu therapierenden Patientenkreis auf denjenigen mit einer relativ großen Erfolgsaussicht zu reduzieren.

Patienten mit primären oder sekundärem Hypogonadismus haben bei Ausschluss von Kontraindikationen (Tabelle 4) eine klare lebenslange Indikation zur Testosterontherapie. Die Auswahl des Testosteronpräparates (Tabelle 5) erfolgt individuell nach Präferenz des Patienten unter Beratung des Arztes. Eine orale Testosterongabe ist aufgrund schlechter Bioverfügbarkeit und häufigem Leberwerte-Anstieg nahezu obsolet. Wird eine Testosterontherapie bei einem Patienten ohne bisherige endogene Pubertät begonnen, muss entsprechend der Physiologie niedrig dosiert begonnen werden.

Ist die laborchemische Diagnose eines funktionellen Hypogonadismus (Abbildung 3) bei einem signifikanten Symptomscore (Tabelle 3) gestellt, besteht grundsätzlich auch die Indikation zur Testosteronsubstitution.
Beim funktionellen Hypogonadismus sollte der Patient vor Therapiebeginn immer auf folgende Zusammenhänge hingewiesen werden:
A) Jede Verbesserung eines beeinflussbaren Effektes (Tabelle 1) führt zu einem Anstieg des endogenen Testosterons und auch meist zu einer Verbesserung der diesbezüglichen Klinik. Sehr gut ist das insbesondere belegt für eine Gewichtsabnahme bei Adipositas, egal ob durch Diät, Medikamente oder bariatrische Chirurgie.
B) Signifikante klinische Effekte sind in placebokontrollierten Studien hauptsächlich bezüglich Libido/verbessertem Sexualleben gezeigt worden. Andere Effekte auf physische oder psychische Vitalität etc. waren vernachlässigbar gering bzw. nicht nachweisbar. Bei Diabetes Typ 2/Adipositas ergaben placebokontrollierte Studien keine signifikanten Effekte der Testosteronbehandlung bezüglich HbA1c, Gewicht, Taillenumfang oder BMI, lediglich leichte Verbesserung der Insulinresistenz.
C) Bezüglich der kardiovaskulären Sicherheit der Testosterongabe bei funktionellem Hypogonadismus ist die Datenlage aufgrund zu kurzer Dauer der Studien und vielen retrospektiven Auswertungen unklar (4;5). Da es auch Studien mit Hinweisen für negative Effekte gibt, sollte man in diesem Kollektiv mit meist hohem Risiko (Diabetes, Alter) vor Testosterontherapie ein besonderes Augenmerk auf eine entsprechende Risikobewertung legen (z. B. negatives Belastungs-EKG im letzten Jahr).
Sollte man sich nach diesem Arzt-Patienten-Gespräch zu einer Testosterontherapie entscheiden, beginnt man vorzugsweise mit den Gelen (Tabelle 5). Wichtig ist, dass bei jeder Vorstellung des Patienten klar die Effektivität der Therapie zu überprüfen ist. Neben dem ärztlichen Gespräch ist hierzu der sogenannte „AMS (Aging Male Scala)-Bogen nach Heinemann“ hilfreich. Wegen geringer Spezifität ist dieser Bogen zur Indikationsstellung nicht sehr valide und abzulehnen. Zur Therapieüberprüfung (vorher/nach) hat er sich im Praxisalltag aber doch als hilfreich erwiesen.

Sollte bei dem Patienten nach 6- bzw. 12-monatiger Therapie keine klinische Besserung unter der Testosteronsubstitution auftreten, sollte diese wieder abgesetzt werden und der Patient auf andere therapeutische Möglichkeiten (z. B. Psychosomatik) hingewiesen werden.
Da intramuskuläre Testosteronapplikationen (Testosteronenanthat, Testosteronundecanoat) meist zu einer LH-Suppression und damit bei Absetzen zu einem passageren iatrogenen Hypogonadismus führen, sollte ein Therapieversuch beim funktionellen Hypogonadismus immer besser mit Gelen durchgeführt werden.
Wenn sich zur dauerhaften Testosteronsubstitution entschlossen wird, sind intramuskuläre Applikationsweisen auch möglich.
Zur Risiko-Überwachung der Therapie werden nach Leitlinie regelmäßige (alle drei Monate) rektale Untersuchungen und Bestimmungen von PSA und Blutbild empfohlen. Eine urologische Konsultation soll erfolgen bei PSA > 4 ng/ml, PSA-Anstieg > 1,4 in 1 Jahr, PSA-Anstieg > 0,4 ng/ml/Jahr, auffälligem Tastbefund und signifikanter Obstruktion bei benigner Prostatahypertrophie.
Die Therapie sollte bei einem Hämatokrit > 54 % abgebrochen bzw. die Testosterondosis reduziert werden.
Fazit für die Praxis
Eine harte Indikation zur Therapie mit Testosteron besteht lediglich bei maximal 5 % aller Patienten, die sich wegen Hypogonadismus in der Praxis vorstellen. Bei den übrigen Patienten liegt ein funktioneller Hypogonadismus vor, der zunächst durch Behandlung der Ursachen therapiert werden soll. Eine Testosterontherapie wird dann nur noch in wenigen Einzelfällen unter Beachtung der zahlreichen Kontraindikationen (insbesondere kardiovaskuläre Erkrankungen) durchgeführt werden.
Interessenkonflikte
Ein Interessenkonflikt wird vom Autor verneint.
Literatur
- Dohle G.R. et al. EAU-Leitlinie Männlicher Hypogonadismus 2019. J Reproduktionsmed Endokrinol 2020; 17: 2-22.
- Bhasin S, Brito JP, Cunningham GR et al.: Testosterone therapy in men with hypogonadism: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 2018; 103: 1715-1744.
- Zitzmann M. Testosterontherapie im Alter bei Hypogonadismus und Komorbiditäten. Internist 2020; 61: 549-557.
- Snyder PJ, Bhasin S, Cunningham GR et al.: Lessons from the Testosterone Trials. Endocr Rev 2018; 39: 369-386.
- Qaseem A, Horwitch CA, Vijan S et al.: Testosterone treatment in adult men with age-related low testosterone: a clinical guideline from the American College of Physicians. Ann Intern Med 2020; 172: 126-133.
vorab online
Dieser Artikel wurde am 1. Februar 2021 vorab online veröffentlicht.
